在识别到与病原相关的分子模式或效应因子后,植物会部署各种机制来预防或限制微生物感染,其中重要的方面之一便是合成与分泌各种次生代谢物。目前报道的涉及植物次生代谢产物转运的转运蛋白集中在ATP-binding cassette(ABC)转运蛋白和Multidrug and toxic compound extrusion (MATE) 转运蛋白。作为ABC转运蛋白的一个亚类,Pleiotropic drug resistance (PDR)/ABC subfamily G (ABCG) 转运蛋白参与了影响植物适应性的重要过程,如病原体应答、扩散屏障形成和植物激素转运等。
植物转运蛋白的磷酸化可以改变蛋白的转运活性、稳定性和胞内定位,并在植物多种成分的转运中发挥重要的调控作用,如糖、生长素、无机营养物质和防御相关化合物等。然而,植物转运蛋白的上游激酶信号途径仍缺乏了解,尤其是次生代谢物相关的转运蛋白。
近日,淮南师范学院缪国鹏博士课题组在Plant Physiology(中科院一区TOP,IF=7.4)发表了题为“AGC kinases OXI1 and AGC2-2 regulate camalexin secretion and disease resistance by phosphorylating transporter PDR6”的研究论文。该研究找到了可以直接磷酸化修饰一种拟南芥中介导camalexin外泌的转运蛋白PDR6的激酶,并对磷酸化位点的功能进行了初步阐释。研究结果有助于揭示植物利用转运蛋白快速响应病原菌侵害的机制,为将来的遗传育种提供了一定参考。

作者们从与PDR类转运蛋白共表达的基因中发现一种AGC类激酶(Orthologs of mammalian PKA, PKG, and PKC kinases)OXI1。通过检测OXI1和它的同源基因AGC2-2突变体叶片分泌camalexin的能力,发现两种激酶与camalexin的胞外分泌以及相应的病原菌抗性相关。体外激酶反应发现,两种激酶可以在体外与三种PDR转运蛋白,PDR6、PDR8和PDR12,进行激酶反应。之后,利用一系列蛋白互作技术证明两种激酶与PDR6的胞内区直接互作。通过LC-MS/MS和平行反应监测,作者们确定了激酶靶向PDR6的磷酸化位点。其中,几丁质诱导了PDR6在特定残基(S31、S33、S827和T832)上的磷酸化。通过在pdr6突变体背景中表达去磷酸化的PDR6变体,研究揭示了目标残基S31、S33和S827促进了PDR6的外流活性,而T832可能有助于维持PDR6在细胞质膜中的稳定性。
几丁质是一种代表性的微生物相关分子模式,可以被植物中的防御蛋白,如拟南芥中的Chitin elicitor receptor kinase 1 (CERK1),所感知,并在广泛的植物物种中触发防御信号传导。几丁质会引发ROS水平的增加,进而诱导OXI1的表达并激活OXI1的活性。除了H2O2外,诱导磷脂酸应激信号也可以通过下游的3-phosphinositide-dependent protein kinase 1介导OXI1的磷酸化。结合本研究的结果,几丁质的识别增加了OXI1的磷酸化水平,进而磷酸化PDR6并增强了其功能。值得注意的是,OXI1可能同时还会磷酸化其他PDR转运蛋白,从而调控拟南芥中各种次生代谢产物的分布。
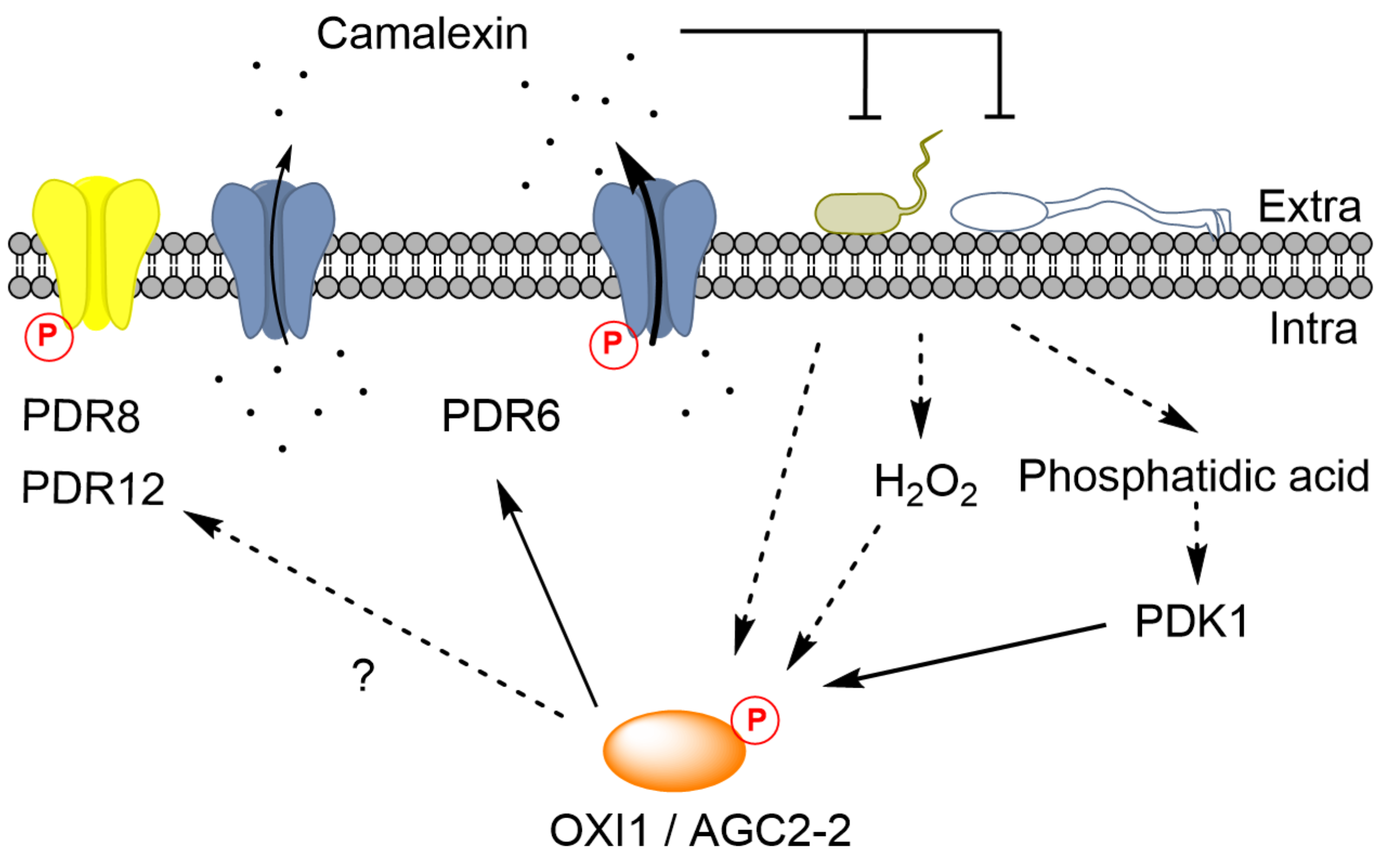
鉴于PDR转运蛋白通常被证明能够运输多种结构无关的化合物,并参与非常多样化的生理过程,未来需要在靶向同一个PDR转运蛋白的不同激酶以及同一PDR转运蛋白不同磷酸化位点之间的关系中进行更深入的研究。




























